A、B、C、D、E为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E处于同一周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,D是地壳中含量最高的金属元素;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),25℃时0.1 mol/L的乙溶液pH>l;D的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐丁,也能与丙的水溶液反应生成盐。
请回答下列问题:
(1)甲的化学式为 ;B单质的电子式为 。
(2)D元素的名称是 。
(3)写出丁溶液中通入过量二氧化碳时的离子方程式
(4)工业上利用A、B的单质合成甲(BA3):B2 (g)+3A2 (g)  2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
(5)E的单质与甲反应生成的乙和丙的物质的量之比为2:4.反应中被氧化的物质与被还原的物质的物质的量之比为 。
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
(1)A的结构简式为。
(2)D分子中的官能团是,
(3)写出下列反应的化学方程式
② ④
(共15分)
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,
写出气体甲的电子式________。
(2)X的化学式是____,在惰性气流中加热X至完全分解的化学方程式为_______________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________________________________________________,
并设计实验方案验证该反应的产物_________________________________________
。
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一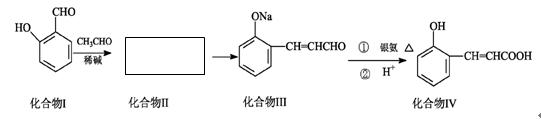
已知: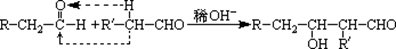
试回答下列问题:
(1)化合物II的结构简式为:
(2)化合物II→化合物III的有机反应类型
(3)化合物III在银氨溶液中发生反应化学方程式
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式
(5)下列说法正确的是()
| A.化合物I遇氯化铁溶液呈紫色 | B.化合物II能与NaHCO3溶液反应 |
| C.1mol化合物IV完全燃烧消耗9.5molO2 | D.1mol化合物III能与3 mol H2反应 |
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为。
(14分)A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物, A、B、C、D、E、F六种物质中均含同一种元素。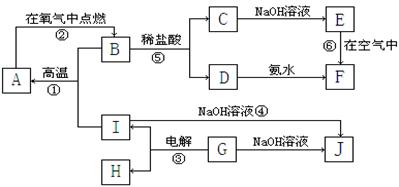
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置是;
(2)检验C溶液中阳离子方法是(写出操作,现象及结论)
;
(3)写出反应①化学方程式:;
(4)写出反应④离子方程式: ;
(5)写出反应⑥化学方程式:;
(6)写出反应③阳极的电极反应式:;
(7)从能量变化角度看,反应①②③中,属于△H<0的反应是(填序号)。
图中各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥,B、D常温常压下是气体。请回答下列问题: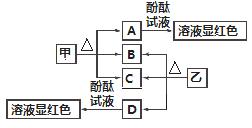
(1)甲的俗名是________。
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,其原理________(填“相同”或“不相同”)。
(3)甲在潮湿的空气中会缓慢分解,A会吸收空气中的水分:A+nH2O===A·nH2O(n为平均值,n≤10),取没有妥善保管的甲样品9.16 g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的B的体积(标准状况)如下表:(溶于水中的B不计)
| 盐酸的体积(mL) |
4 |
8 |
15 |
20 |
50 |
120 |
150 |
| 生成B的体积(mL) |
0 |
0 |
112 |
224 |
896 |
2240 |
2240 |
则:
① 稀盐酸的物质的量浓度为__________________________________。
② 样品中的成分及其物质的量分别为__________________________________。