25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和12。下列说法正确的是
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
下列说法正确的是( )
| A.因为p轨道是“8”字形的,所以p电子走“8”字形 |
| B.第三电子层,有3s、3p、3d三个轨道 |
| C.氢原子中只有1个电子,故氢原子只有一个轨道 |
| D.原子轨道与电子云都是用来形象描述电子运动状态的 |
外围电子排布式为3d104s1的元素在周期表中应位于( )
| A.第四周期ⅠB族 | B.第五周期ⅡB族 |
| C.第四周期ⅦB族 | D.第五周期ⅢB族 |
下列有关表述正确的是( )
| A.硫离子的电子排布式:1s22s22p63s23p4 |
B.H2O的电子式: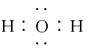 |
C.N原子最外层电子的轨道表示式: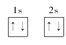  |
D.K的原子结构示意图: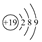 |
在d轨道中电子排布成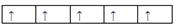 ,而不排成
,而不排成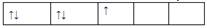 最直接的根据是 ( )
最直接的根据是 ( )
| A.能量最低原理 | B.泡利不相容原理 |
| C.洪特规则的特例 | D.洪特规则 |
推算原子序数为6、13、34、53、88的元素在周期表中的位置。
| 原子序数 |
6 |
13 |
34 |
53 |
88 |
| 周期 |
|||||
| 族 |