25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
| D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
在一定条件,将A2和B2两种气体通入1 L密闭容器中,发生反应:xA2(g)+yB2(g) 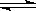 2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v (C)=1 mol·L-1·s-1。则x和y的值分别为:
2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v (C)=1 mol·L-1·s-1。则x和y的值分别为:
A.1和3 B.3和1C.2和3D.3和2
在下列溶液中,能大量共存的一组离子是:
| A.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| D.由水电离出的c(H+)=1×10-13 mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法错误的是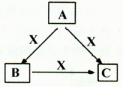
A.若X为O2,则A可为硫化氢
B.若X为KOH溶液,则A可能为AlCl3
C.若X为Fe,则C可能为Fe(NO3)2
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列选项正确的是:
| A.元素非金属性:Z>Y>X | B.气态氢化物的稳定性:Z<Y<X |
| C.原子半径:Z<Y<X | D.最高价氧化物对应水化物的酸性:Z>Y |
下列各组物质相互混合反应后,最终有白色沉淀生成的是:
①金属钠投入到FeCl2溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向NaAlO2溶液中通入过量CO2 ;
⑤向饱和Na2CO3溶液中通入过量CO2 ; ⑥向水玻璃溶液中加入过量盐酸。
| A.①③④⑤ | B.③④⑤⑥ | C.②③⑥ | D.①④⑥ |