下列生实验事实或结论均正确的是
| 选项 |
事实 |
结论 |
| A |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比Mg(OH)2的小 |
| B |
 |
记录滴定终点读数为12.20mL |
| C |
Mg(OH)2固体在溶液中存在平衡: Mg(OH)2(s)  Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
该固体不溶于NH4Cl溶液 |
| D |
镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生同时测得溶液的pH为8.6 |
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生,弱碱性溶液中OH- 氧化了Mg |
下列说法正确的是
| A.瑞典化学家阿累尼乌斯提出了酸碱质子理论,扩大了人们对酸碱的认识 |
| B.活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物 |
| C.使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 |
| D.质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 |
下列有关电解质溶液说法都正确的是
| A.将10ml0.1mol·L-1Na2CO3溶液逐滴滴加到10ml0.1mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| B.物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 |
| C.向0.1 mol·L-1 FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4 溶液不褪色,说明FeCl3溶液只有氧化性,无法被氧化剂氧化 |
| D.把AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3的溶液,可观察到大量淡黄色沉淀与少量白色沉淀生成,说明反应后AgCl与AgBr沉淀应都有,但是以AgBr为主,说明Ksp(AgCl)>Ksp(AgBr) |
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、 Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为
| A.MgSO4 | B.Ba(HCO3)2 | C.Mg(HCO3)2 | D.Ba(OH)2 |
下列说法正确的是
| A.苯中含有的苯酚杂质可通过加入足量溴水后过滤的方法而除去 |
| B.苯乙烯中至少有8个碳原子在同一个平面 |
| C.等质量的乙烯和聚乙烯完全燃烧,产生的二氧化碳的质量之比为1:1 |
| D.分子式为C5H10O2且可与氢氧化钠溶液反应的有机化合物有14种(不考虑立体异构) |
利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是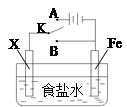
| A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 |
B.若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O 2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑ |
| C.若X为碳棒,开关K置于B处,在铁棒附近滴入铁氰化钾溶液可看到溶液变血红色 |
| D.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |