海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
| 模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。 下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
为了避免或减少污染环境,科学家研制出多种新型杀虫剂,以代替DDT,右图的化合物就是其中的一种。下列关于该化合物说法不正确的是 ( )。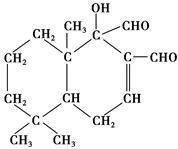
| A.该化合物不属于芳香烃 |
| B.在一定条件下,可以发生加成反应 |
| C.在一定条件下,可以发生酯化反应 |
| D.该化合物能溶于水 |
为了探究植物吸水和吸收矿质离子的特点和关系,用相同的培养液,分别培养水稻和番茄幼苗。培养一段时间后,分别测定培养液中各种养分的百分含量,并与原培养液(各种养分的相对百分含量100%)中各种养分的百分含量比较,结果如图所示。请据图回答相关问题:
(1)水稻的培养液中,Mg2+的相对浓度比原来升高了,这是由于水稻______________________________________________________________。
(2)番茄的培养液中,Mg2+和Si4+的浓度变化不同,说明______________________________________________________________。
(3)培养水稻和番茄的培养液中,Si4+的浓度变化不同,说明______________________________________________________________。
(4)为使上述结果反映水稻和番茄吸水和吸收矿质营养的特点,除把实验装置放在同一环境中外,还应将培养容器密封好,防止________;注意调节培养液的酸碱度,并经常(每天2~3次)向培养液中通入________,保证根细胞______________________________________________________________。
现有质量分数为15%的食盐溶液20 g,质量分数为40%的食盐溶液15 g,另有足够多的食盐固体和水,要配制质量分数为20%的食盐溶液30 g。
(1)试选择多种可能的配制方法(至少四种)。
(2)若要求尽可能多地使用现有的食盐水,应如何配制?
在无土栽培中,需配制一定量含50 mol NH4Cl、16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)( )。
| A.2、64、24 | B.64、2、24 |
| C.32、50、12 | D.16、50、24 |
科学家在利用无土栽培培养一些名贵花卉时,培养液中添加了多种必需元素,其配方如下,其中植物根吸收最少的离子是( )。
| 离子 |
K+ |
Mg2+ |
Ca2+ |
NO3- |
H2PO4- |
SO42- |
Zn2+ |
 |
1 |
0.25 |
1 |
2 |
1 |
0.25 |
1 |
A.Zn2+B.SO42-C.Ca2+D.H2PO4-