常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是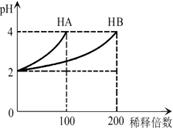
A. 稀释前,c(HB) > c(HA)="0.01" mol·L-1
B. HB的电离方程式为HB=H++B-
C. NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+)
D. NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
下列反应属于放热反应的是( )
| A.液态水气化 | B.将胆矾加热变为白色粉末 | C.浓硫酸稀释 | D.氧化钙溶于水 |
100 mL 2 mol/L H2SO4与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是()
| A.加入碳酸钠固体 | B.改用18 mol/L的浓H2SO4 |
| C.滴入少量硫酸铜溶液 | D.加入硫酸钾溶液 |
下列结论正确的是()
①粒子半径:K+>Al3+>S2->Cl-②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有②⑤⑦ | B.②⑥⑦ | C.②④⑤⑥⑦ | D.②④⑥ |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
关于919F-微粒叙述正确的是( )
| A.质量数为19,电子数为9 | B.质子数为9,中子数为10 |
| C.质子数为9,电子数为9 | D.中子数为10,电子数为8 |