下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
共价键的断裂有均裂和异裂两种方式,即均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是
| A.2K+2H2O=2KOH+H2↑ |
| B.2Na+2C2H5OH → 2C2H5ONa+H2↑ |
C.Na2CO3+H2O NaHCO3+NaOH NaHCO3+NaOH |
D.CH3COOH+C2H5OH  H2O+CH3COOC2H5 H2O+CH3COOC2H5 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为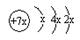 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为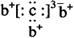 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a>c>d>b | B.电负性a>b>d>c |
| C.原子序数:a>d>b>c | D.最高价含氧酸的酸性c>d>a |
下列化合物中含有手性碳原子的是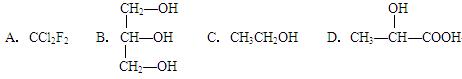
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。试推测ICl的沸点所处的范围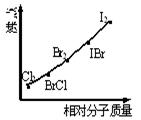
| A.Cl2和BrCl之间 | B.Br2和IBr之间 | C.IBr和I2之间 | D.BrCl和Br2之间 |
有关晶体的说法不正确的是
| A.都有自范性 | B.都是无色透明的 | C.有各向异性 | D.有固定熔点 |