已知t ℃时,0.01 mol·L-1NaOH溶液的pH="11,0.1" mol·L-1的HA溶液中c(H+)/c(OH-)=109。请回答下列问题:
(1) 该温度下,水的离子积KW= ,HA是 (填“强”或“弱”) 酸。
(2) 该温度下,将pH之和为13的NaOH溶液和HA溶液等体积混合后,所得溶液呈 (填“酸”、“碱”或“中”) 性。
(3) 在室温下,用蒸馏水稀释0.01 mol·L-1 HA溶液时,下列各项呈减小趋势的是 。
A.c(H+)/c(A-)
B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积
D.溶液中c(A-)·c(HA)的值
E.水的电离程度
(4) 室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

①图中表示HA溶液pH变化曲线的是 (填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1 m2(填“>”、“<”或“=”)。
随着石油价格的提高,化学工作者正在研究以天然气和醇类合成优质汽油的方法。合成路线如下: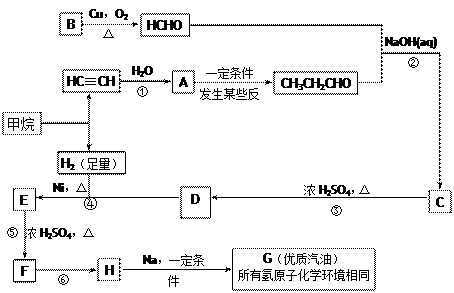
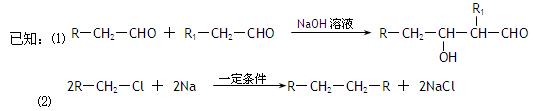
试回答下列问题:
(1)在反应①—⑦中,属于加成反应的是,属于消去反应的是。
(2)写出下列反应的化学方程式E→F;H→G
(3)C的具有相同官能团的同分异构体(包括C)有种。
(4)根据题给信息,写出用乙炔和苯及必要的无机试剂合成对二苯基环丁烷(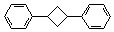 )的合成路线如下:
)的合成路线如下: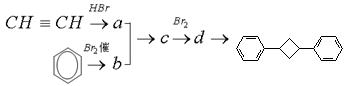
请写出a、b、c、d的结构简式:a; b; c; d.
X、Y、Z三种短周期元素,其单质在常温下都是无色气体,它们的原子序数之和为16。在适当条件下三种单质直接化合,可发生如右图所示变化。已知一个B分子中含有Z元素的原子个数比 C分子中的Z元素的原子个数少一个。
请回答下列问题:
(1)X元素在周期表中的位置X、Z两元素也可按1:1组合成另一种物质D,D 的电子式为,A与C在一定条件下可生成无污染的物质,请写出该反应的化学方程式
(2)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液pH7(填“大于”、“小于”或“等于”)其原因是( 用离子方程式表示):。
用离子方程式表示):。
(3)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温,恒压条件下反应。下列说法中,正确的是(填写下列各项的序号)。
a.达到化学平衡后,再升高温度,C的体积分数增大
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.反应过程,Y的单质体积分数始终为50%
d.达到化学平衡的过程中,混合气体的密度增大
e.达到化学平衡时,正反应速率与逆反应速率相等
钡盐生产中会排出大量的钡泥[主要含有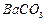 、
、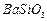 、
、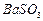 、
、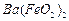 等]。某化工厂主要生产
等]。某化工厂主要生产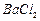 、
、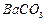 、
、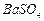 ,现利用钡泥制取
,现利用钡泥制取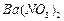 ,其部分工艺流程如下:
,其部分工艺流程如下: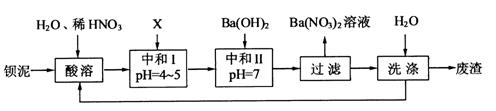
(1)酸溶后溶液中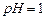 ,
,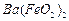 与
与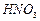 的反应化学方程式为。
的反应化学方程式为。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,其原因是
、。
(3)该厂结合本厂生产实际选用的X为(填化学式);“中和Ⅰ”会使溶液中(填离子符号)的浓度减少(“中和Ⅰ”引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。请回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为_____________,B的结构式为____________。
⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:_____________________;由R生成Q的化学方程式:________________________。
有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为:
请回答下列问题:
(1)A的分子式为。
(2)A与氢氧化钠溶液反应的化学方程式为。
(3)两个氨基乙酸分子 ,在一定条件下反应可生成
,在一定条件下反应可生成 ;
;
两个A分子在一定条件下生成的化合物结构简式为。
(4)符合下列4个条件的同分异构体有6种,写出其中三种。
①1,3,5-三取代苯②遇氯化铁溶液发生显色反应
③氨基与苯环直接相连④属于酯类