碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源, 选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
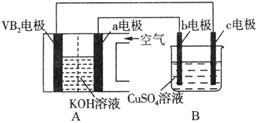
| A.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| B.外电路中电子由c电极流向VB2电极 |
| C.VB2电极发生的电极反应为: 2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是
①HI②氯化亚铁③甲苯④丙烯⑤SO2⑥焦炉气
| A.除①外 | B.除②外 | C.除③外 | D.除⑥外 |
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键或两种键都有
②熔融状态下能导电的化合物一定是离子化合物
③共价化合物不含离子键
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①②③ | B.②④⑤ | C.②③④ | D.①③⑤ |
在固定体积的密闭容器中进行如下反应:2AB2(g)+B2(g) 2AB3(g)。已知反应过程某一时刻AB2、B2、AB3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时,浓度可能正确的是
2AB3(g)。已知反应过程某一时刻AB2、B2、AB3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时,浓度可能正确的是
| A.AB2、B2分别为0.4mol/L、0.2mol/L |
| B.AB2为0.25mol/L |
| C.AB2、AB3均为0.15mol/L |
| D.AB3为0.4mol/L |
在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g)。下列不能说明该反应已达到化学平衡状态的是
2NO2(g)。下列不能说明该反应已达到化学平衡状态的是
| A.反应容器中压强不随时间变化而变化 |
| B.混合气体颜色保持不变 |
| C.混合气体的密度保持不变 |
| D.各物质的物质的量浓度保持不变 |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③若有0.5mol电子流经导线,则可产生5.6LH2
④SO 向Zn极移动
向Zn极移动
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-====Cu2+,
发生氧化反应则卡片上的描述合理的是
| A.②④ | B.②③ | C.③④ | D.④⑥ |