工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是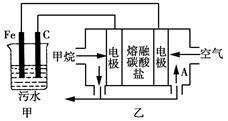
| A.为了增加污水的导电能力,应向污水中加入适量的CH3CH2OH溶液 |
| B.甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L |
“金属冶炼技术改变了世界”;下列各项中“能用热分解法制得的金属”是
| A.Na | B.Mg | C.Fe | D.Ag |
“化学使生活更美好”;炒菜时,加一点酒和醋能使菜味香且可口,其原因之一是:
| A.有多糖物质生成 | B.有盐类物质生成 |
| C.有油脂物质生成 | D.有酯类物质生成 |
“石油是今日世界各国的经济与军事等的命脉”;石油催化裂化的目的是:
| A.提高汽油等轻质油的产量 | B.除去石油中的杂质 |
| C.使直链烃分子转化为芳香烃 | D.对石油进行分离的一种方法 |
一定温度下可逆反应N2(g) + 3H2(g) 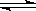 2NH3(g) 达平衡的标志是
2NH3(g) 达平衡的标志是
| A.v正(N2) = v逆(NH3) | B.v正(N2) = 3v正(H2) |
| C.v正(H2) =" 3/2" v逆(NH3) | D.N2、H2、NH3的体积比为1︰3︰2 |
在反应3H2+N2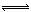 2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为
2NH3中,经一段时间后,氨的浓度增加了0.6 mol/L,在此时间内用H2表示的平均反应速率为O.45 mol/(L·s),则反应所经历的时间为
| A.0.44 s | B.1 s | C.O.33 s | D.2 s |