设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
| B.一定温度下,1 L 0.50 mol·L-1 NH4NO3溶液中含氮原子个数为NA |
| C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
D.235g核素 U发生裂变反应: U发生裂变反应: U+ U+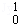 n n 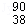 Sr+ Sr+ Xe+10 Xe+10 n,净产生的中子( n,净产生的中子(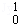 n)数为10NA n)数为10NA |
在实验室不宜长期保存,必须现用现配的是()
①溴水②银氨溶液③石灰水④氯水⑤氢硫酸
⑥NaOH溶液⑦FeSO4溶液⑧FeCl3溶液⑨CuSO4溶液⑩醋酸
| A.②③④⑧⑨ | B.⑤⑦⑧⑨⑩ | C.②③④⑤⑦ | D.①⑥⑧ |
Na2O2、Cl2、SO2等均能使品红溶液褪色。下列说法正确的是()
| A.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 |
| B.标准状况下,1 mol Na2O2和22.4LSO2反应,转移电子数目为NA |
| C.等物质的量Cl2和SO2同时通入品红溶液,褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平。A、B、C、D、E有下图所示的关系(反应条件省略)。则下列推断正确的是( )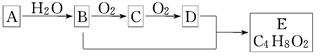
A.鉴别A和甲烷可选择酸性高锰酸钾溶液
B.只有D能与金属钠反应
C.物质C的结构简式为CH3CHO
D.B+D→E的化学反应方程式为:
CH3CH2OH+CH3COOH CH3COOC2H5
CH3COOC2H5
乙醇分子中不同化学键如图所示,关于乙醇在有关反应中断裂键的说明不正确的是()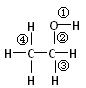
| A.与金属钠反应时键①断裂 | B.消去反应时键②、③断裂 |
| C.与HBr反应时②断裂 | D.氧化生成醛时②、④断裂 |
下列反应不属于取代反应的是()
| A.溴乙烷与氢氧化钠水溶液共热 | B.溴乙烷与氢氧化钠的乙醇溶液共热 |
| C.苯与浓硝酸在一定条件下反应生成硝基苯 | D.乙炔与氯化氢在一定条件下制氯乙烯 |