硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) ΔH=-457kJ/mol
②SO3(g) +H2O(l)=H2SO4(l) ΔH=-130kJ/mol
则SO2催化氧化为SO3(g)的热化学方程式为__________________。
(2)对于SO3催化氧化为SO3的反应。
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为________________。
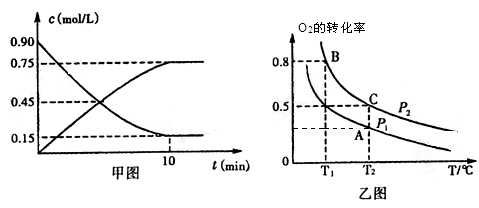
②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1________________ P2(填>、=或<);A、B、C三点的平衡常数大小关系为____________(用KA、KB、KC和 >、=、<表示),理由是______________________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3)
B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3∙H2O)-c(H2SO3)
D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中各离子浓度由大到小的顺序为_____________________。
| |
NH3·H2O |
H2SO3 |
|
| 电离平衡常数(mol/L) |
1.7×10-5 |
Ka1 |
Ka2 |
| 1.54×10-2 |
1.02×10-7 |
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水。观察现象,完成下表。
| 乙醇与钠反应的现象 |
气体燃烧的现象 |
检验产物 |
| 气体燃烧时火焰呈, 小烧杯内壁, 澄清石灰水。 |
反应中只生成了 |
写出乙醇与钠反应的化学方程式
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系: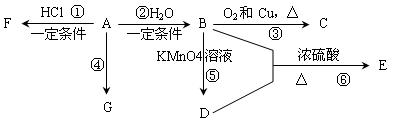
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为:___________________________________,该反应类型是_______________;
如何除去E中所混有少量的D杂质,简述操作过程:________________________________________
______________________________________________________________________________________;
(3)G是一种高分子化合物,其名称是_____________,链节是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:________________________________,该反应的原子利用率为__________,决定F能用于冷冻麻醉应急处理的性质是________________________________
__________________________________________。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,B和C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数比K、M两个电子层上的电子数之和少1。A的氢化物遇到D的氢化物会产生大量白烟F。请回答下列问题:
(1)A在周期表中和位置__________________;D的最高价氧化物的水化物化学式是_____________。
(2)写出E与水反应的化学方程式:__________________________________________。
(3)E属于__________(填“离子”或“共价”)化合物。它的电子式为:________________。
(4)A的氢化物遇到D的单质也会发生反应产生大量白烟,同时生成A的单质,请写出该反应的化学方程式:____________________________________。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)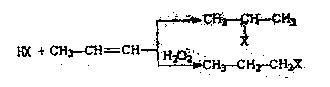 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合作结构简式为的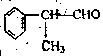 物质,该物质是一种香料。
物质,该物质是一种香料。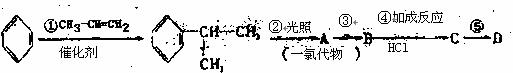
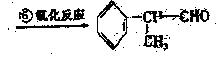
请根据上述路线,回答下列问题:
(1)A的结构简式可能为或。
(2)反应①、③、⑤的反应类型分别为、、。
(3)物质B中的官能团的名称是。
(4)反应④的化学方程式为(有机物写结构简式,并注明反应条件)。
(5)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是。
(6)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种)。
已知A和B是具有相同碳原子数的一氯代物,A-I转换关系如图所示: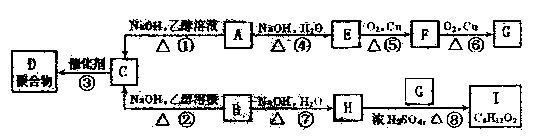
根据框图回答下列问题:
(1)B的结构简式是;
(2)反应③的化学方程式是 ;
;
(3)上述转换中属于取代反应的是(填写反应序号)。
(4)图中与E互为同分异构体的是(填化合物代号) 。
。
(5)C在硫酸催化下与水反应的化学方程式是;
H在铜催化下与氧气反应的化学方程式是。
(6)I的结构简式是,用习惯命名法,其名称是。