某工厂采用电解法处理含铬废水,耐酸电解槽阴、阳极,槽中盛放含铬废水,原理示意如右图,下列说法不正确的是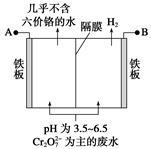
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O |
| C.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
| D.阴极区附近溶液pH降低 |
下列关于实验或说法正确的是()
| A.SO2能使品红溶液、酸性KMnO4溶液褪色,加热后都能复原 |
| B.用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+ |
| C.用滴加BaCl2溶液,观察有无白色沉淀的方法来鉴别K2CO3和NaHCO3 |
| D.少量CO2通过CaCl2的溶液能生成白色沉淀,过量CO2时白色沉淀溶解 |
下列实验与对应的图象符合的是()
| A.①是向一定量的CH3COOH溶液中通入氨气 |
| B.②是向等物质的量的HCl和AlCl3溶液中滴入NAOH溶液至过量 |
C.③是对于达到平衡状态的 反应,在t1时缩小容器 反应,在t1时缩小容器 |
| D.④是将PH=2的盐酸和醋酸分别加水稀释 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是()
| A.W的原子序数可能是Y的原子序数的2倍 |
| B.Z元素的原子半径可能比Y元素的小 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的化学活泼性一定比X强 |
下列实验设计和结论相符合的是()
| A.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体一定显碱性 |
| C.将SO2通入酸性高锰酸钾溶液中,溶液的紫色褪去,说明SO2具有漂白性,加热后不会复原 |
| D.某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
A、B、C、D、E 五种短周期元素,核电荷数依次增加。只有D为金属,A 与D 同主族,C与E同主族,B 原子最外层电子数是内层电子数的2 倍,D+与C3-具有相同的电子层结构。下列说法正确的是()
A.B的氧化物可引起光化学烟雾
B.A与D同属碱金属族
C.C的氢化物与C的最高价氧化物的水化物能发生化合反应
D.离子半径:D+>C 3-