在实验中,下列除去杂质的方法正确的是
①乙烷中混乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏;
⑤溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴;
⑥硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置后再过滤.
| A.①②③⑥ | B.②④ | C.②③④ | D.②③④⑥ |
空气质量指数(AirQualityIndex,AQI)是定量描述空气质量状况的非线性无量纲指数。参与评价的污染物为SO2、NO2、PM10、PM2.5、O3、CO等六项。下列措施不能有效改善空气质量的是
| A.调整产业结构,淘汰落后产能 |
| B.改善能源结构,使用清洁能源 |
| C.控制工业源污染,对钢铁、水泥等行业实行限产、限污 |
| D.及时发布AQI指数,提示公众应对污染的措施 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )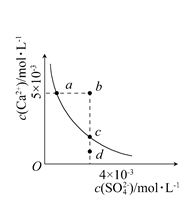
| A.在任何溶液中,c(Ca2+)、c(SO42—)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )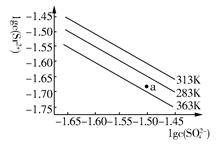
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
下列说法中正确的是 ( )
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) |
| D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是 ( )
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |