工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
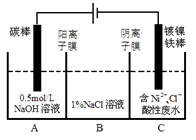
已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
从氧化还原反应的角度看,在实验室制取①H2 ②CO2 ③Cl2的三个反应中,盐酸的作用
| A.互不相同 | B.在①和②中相同 |
| C.在②和③中相同 | D.在①②③中均相同 |
泡沫灭火器内装的药液之一是饱和NaHCO3溶液,而不选用更廉价的饱和Na2CO3溶液。其原因是
①NaHCO3比Na2CO3稳定,便于长期保存
②NaHCO3与酸反应产生气泡比Na2CO3快
③质量相同的两种钠盐,NaHCO3与足量酸反应产生CO2气体多
④产生相同质量的CO2,消耗的酸量NaHCO3比Na2CO3少
| A.②③④ | B.①②③④ | C.①②③ | D.①③④ |
为了检验某固体物质中是否含有NH4+,下列组合正确的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
| A.①③ | B.④⑤ | C.①②③ | D.①④⑤ |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.常温常压下,48 g O2和48 g O3 含有的氧原子数均为3NA |
| B.1 mol∙L−1 NaCl溶液中含有Na+的个数为NA |
| C.22.4L N2所含分子数为NA |
| D.标准状况下,22.4 L的SO3中含有NA个SO3分子 |
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是
| A.NaIO3是氧化剂,HSO3-是还原剂 |
| B.生产中可得到副产物H2SO4和Na2SO4 |
| C.I2既是氧化产物又是还原产物 |
| D.HSO3-的还原性比I- 弱 |