(1)如图1是一种新燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
①写出A极发生的电极反应式______________________;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与____________极(填:“C”或“D”)相连;
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过__________克。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_________(填“阴”或“阳”)极移动,阳极的电极反应式为______________;
②若阳极有28gFe溶解,则阴极析出的气体在标准状况下的体积为___________L。
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72 L(标准状况下)。有机物A的实验式为____________________。
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如下图所示,则A的结构简式为____________________。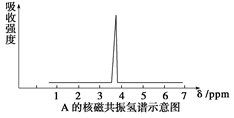
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是____________________________________________。
完成下列化学方程式
①向苯酚钠溶液中通入少量CO2
②以甲苯为主要原料制TNT(三硝基甲苯)
③溴乙烷与NaOH的乙醇溶液共热
④甲醛与新制的Cu(OH)2反应 ______________________________________________
⑤乳酸(2-羟基丙酸)分子间酯化为六元环酯的反应
化学与生产、生活息息相关。现有下列6种有机物:①乙炔②涤纶③甲醛④油脂⑤苯酚⑥淀粉,请将相应的序号填入空格内。
(1)水溶液(俗称福尔马林)具有杀菌防腐性能的是___________:
(2)可用于杀菌消毒、制造阿司匹林等,俗称石炭酸的是___________;
(3)通常用于制肥皂的是___________;
(4)能水解生成葡萄糖供机体利用,还可用于酿制食醋、酒的是___________;
(5)属于合成纤维的是___________;
(6)常用来焊接或切割金属的是___________。
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验。
实验1:铜与浓硫酸反应,实验装置如图所示。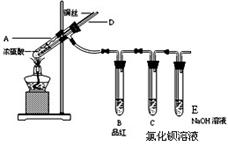
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面;
(1)能够证明铜与浓硫酸反应产生的气体的现象:。
(2)在盛有氯化钡溶液的C试管中除了导管口有气泡外,无其他明显现象,若将其分为两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
__________________________ |
__________________________ |
写出其中SO2显示还原性的离子方程式:。
(3)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是:。
(4)将SO2气体通入含有n mol Na2S溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体mol。 (不考虑溶解的SO2)。
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下: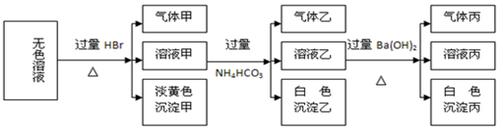
试回答下列问题:
(1)生成沉淀甲的离子方程式为:。
(2)由溶液甲生成沉淀乙的离子方程式为。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 |
实验目的 |
试剂 |
现象 |
| 1 |
|||
| 2 |
|||
| 3 |
检验CO2 |
澄清石灰水 |
溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有:。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是。