设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA |
| B.22.4LHCl中的分子数为NA |
| C.Na2O2与水充分作用生成0.1molO2时转移的电子数为0.2NA |
| D.0.1mol铁与足量盐酸反应转移的电子数为0.3NA |
下列有关实验操作 、现象和解释或结论都正确的是
、现象和解释或结论都正确的是
| 操作 |
现象 |
结论 |
|
| A |
向Na2CO3稀溶液中通入足量CO2 |
溶液变浑浊 |
析出了NaHCO3 |
| B |
向无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
Al箔插入稀HNO3中 |
无现象 |
Al箔---表面被HNO3氧化,形成致密的氧化膜 |
| D |
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是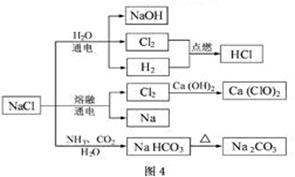
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.上图所示转化反应都是氧化还原反应 |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S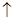 |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3- |
| D.少量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为 |
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
A、B、C、D、E为五种原子序数依次增大的短周期元素。B、C、D形成的氢化物所含电子数相等,B与D可形成BD2直线形分子; E的最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。下列说法正确的 是
是
A.第一电离能:B<C<D
B.A2D2、B2A2、E2D2也为直线型的共价化合物
C.由B元素形成的单质一定是原子晶体
D.由A、D、E三种元素形成的化合物与A、B、D、E四种元素形成的化合物可以发生反应