向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知::2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是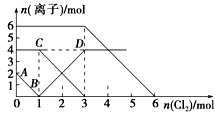
| A.线段BD表示Fe3+物质的量的变化 |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
已知AgCl、AgBr的溶解度分别为1.5×10-4g、8.4×10-6 g(20℃)。将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 | D.AgCl沉淀多于AgBr沉淀 |
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.气态氢化物的稳定性:Z < Y < X |
| B.最高价氧化物水化物酸性:Z > Y |
| C.原子半径:Z < Y < X |
| D.元素非金属性:Z> Y > X |
【改编】下列说法不正确的是
| A.热化学方程式中化学计量数不可以表示粒子的数目 |
| B.在不同条件下同一种物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C.一个反应能否自发进行只与焓变和熵变有关 |
| D.在0.1mol·L-1的氨水中,c(NH3)+c(NH4+)+c(NH3·H2O)=0.1mol·L-1 |
下列有关化学用语使用正确的是
A.CH4分子的比例模型: |
B.H2O2的电子式: |
C.硫原子的结构示意图: |
| D.醋酸的结构简式:C2H4O2 |
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
| A.胆矾、漂白粉、氯化钾、氯气 |
| B.冰醋酸、福尔马林、硫酸钠、乙醇 |
| C.单甘油酯、混甘油酯、苛性钾、石灰石 |
| D.盐酸、水煤气、醋酸、干冰 |