对4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl,下列说法错误的是
| A.Fe(OH)3既是氧化产物又是还原产物 |
| B.氧气是氧化产物 |
| C.做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1 |
| D.过氧化钠只做氧化剂 |
用石灰水保存鲜蛋是一种化学保鲜法。石灰水能保存鲜蛋的原理是( )
①石灰具有碱性,杀菌能力强;
②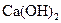 能与鲜蛋呼出的
能与鲜蛋呼出的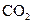 反应,生成碳酸钙薄膜,起保护作用;
反应,生成碳酸钙薄膜,起保护作用;
③石灰水是电解质溶液,能使蛋白质凝聚;
④石灰水能渗入蛋内中和酸性物质。
| A.①② | B.③④ | C.②④ | D.①③ |
导致酸雨和加剧温室效应的主要原因是( )
| A.大量砍伐森林 | B.燃烧煤和大量排放CO2气体 |
C.水土流失 |
D.汽车排放尾气剧增 |
鉴别两种食盐水和蔗糖水的方法有( )
①在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,微热;②测量溶液的导电性;③将溶液与溴水混合.振荡;④用舌头尝味道。
其中在实验室进行鉴别的正确方法是
A. ①② ①② |
B.①③ | C.②③ | D.③④ |
一氧化碳中毒的原因是( )
A.一氧化碳阻碍了血液循环 |
B.一氧化碳麻痹了人体的呼吸系统 |
| C.一氧化碳造成人体呼吸系统停止活动 | D.一氧化碳阻碍了氧气运输 |
下列说法正确的是( )
A.废旧电池应集中 回收,并填埋处理 回收,并填埋处理 |
| B.充电电池放电时,电能转变为化学能 |
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有 关 关 |
| D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |