将标准状况下的V L HCl溶于1000g水中,得到的盐酸密度为ρ g/cm3,则该盐酸的物质的量浓度为
A.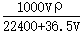 mol/L mol/L |
B.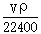 mol/L mol/L |
C. mol/L mol/L |
D.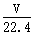 mol/L mol/L |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.0.1 mol羟基中含有的电子数为0.7 NA |
| B.28g Fe与足量稀硝酸反应,转移的电子数为NA |
| C.将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA |
| D.0.5 mol/LAl2(SO4)3溶液中含有SO42-的数目为1.5 NA |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是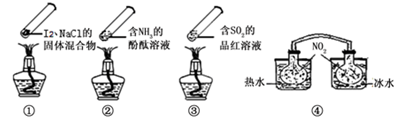
| A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B.加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C.四个“封管实验”中都有可逆反应发生 |
| D.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
下列各组物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①铁与稀硝酸 ②碘化亚铁溶液与溴水 ③碳酸钠溶液与稀盐酸 ④铁与氯气
| A.①②③ | B.①②③④ | C.②③ | D.③④ |
下列叙述错误的是
| A.Al2(SO4)3可除去酸性废水中的悬浮颗粒 |
| B.氯气与石灰乳反应能得到含氯漂白剂 |
| C.燃煤时加入适量石灰石,可减少废气中SO2的排放 |
| D.工业上硝酸可用于制化肥、炸药和染料等 |
在2 L的密闭容器中进行如下反应:CO(g)+H2O(g) CO2(g)+H2(g),有如下数据:
CO2(g)+H2(g),有如下数据:
| 实验 |
温度/℃ |
起始量/mol |
平衡量/mol |
|||
| CO |
H2O |
CO2 |
H2 |
CO2 |
||
| 1 |
650 |
2.0 |
1.0 |
0 |
0 |
0.8 |
| 2 |
800 |
2.0 |
2.0 |
0 |
0 |
1.0 |
下列说法正确的是
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=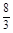
D.实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol