室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| |
加入的物质 |
结论 |
| A |
50mL 1 mol/LH2SO4 |
反应结束后,c(Na+)=c(SO42-) |
| B |
0.05molCaO |
溶液中c(OH-) /c(HCO3-) 增大 |
| C |
50mL H2O |
由水电离出的c(H+)·c(OH—)不变 |
| D |
0.1molNaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为:Ag2O + Zn + H2O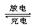 2Ag + Zn(OH)2,则下列说法正确的是
2Ag + Zn(OH)2,则下列说法正确的是
| A.放电时Ag2O参与反应的电极为负极 |
B.放电时 负极附近的pH逐渐减小 负极附近的pH逐渐减小 |
| C.充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移1 mol电子 |
下列说法正确的是
| A.乙醇和乙酸都能与氢氧化钠溶液反应 | B.乙烯和苯都能发生加成反应 |
| C.淀粉和蛋白质水解产物都是氨基酸 | D.葡萄糖和蔗糖都可发生银镜反应 |
在容积不变的密闭容器中进行反应:2SO2 ( g )+O2( g)  2SO3(g ) ;△H < O。下列各图表示当
2SO3(g ) ;△H < O。下列各图表示当 其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻通人氦气对反应速率的影响 |
| C.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| D.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
已知:Fe2O3(s)+C(s)===CO2(g)+2Fe(s) ΔH=+234.14 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则2Fe(s)+O2(g)===Fe2O3(s)的ΔH是
| A.-824.39 kJ·mol-1 | B.+ 627.6 kJ·mol-1 |
| C.-744.7 kJ·mol-1 | D.-169.4 kJ·mol-1 |
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是
| R |
||
| X |
Y |
Z |
| A.Y的氢化物比R的氢化物稳定 |
| B.原子半径大小顺序是Z>Y>X |
C.Y、R形成化合物的化合物YR2能使KMn O4溶液褪色 O4溶液褪色 |
| D.X、Z可形成化合物XZ3,且该化合物属离子化合物 |