已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中正确的是
| A.BaCO3可以转化为BaSO4,反过来则不行 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) = Ksp(BaCO3) / Ksp(BaSO4) |
| D.常温下,BaCO3固体若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度须大于2.2×10-6 mol·L-1 |
除去下列各组物质中的杂质选用的试剂和方法均最合理的是
| 物质 |
杂质 |
试剂 |
方法 |
|
| A |
苯 |
苯酚 |
溴水 |
过滤 |
| B |
二氧化碳 |
二氧化硫 |
澄清石灰水 |
洗气 |
| C |
氧化铁 |
二氧化硅 |
氢氧化钠溶液 |
过滤 |
| D |
乙酸乙酯 |
乙酸 |
饱和碳酸钠溶液 |
蒸馏 |
指常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 |
H-H |
F-F |
H-F |
H-Cl |
H-I |
| E(kJ·mol-1) |
436 |
157 |
568 |
432 |
298 |
A.432 kJ·mol-1>E(H-Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H (g)∆H=+436 kJ·mol-1
D.H2(g)+F2(g)=2HF(g)∆H=—25 kJ·mol-1
下列实验不能达到目的的是
| A.向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B.向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C.铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 |
| D.将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是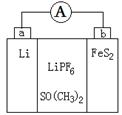
| A.该装置将化学能转化为电能 |
| B.电子移动方向是由a极到b极 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
下列说法正确的是
A.32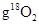 中含有的氧原子数是2×6.02×1023 中含有的氧原子数是2×6.02×1023 |
| B.N2和CO共1mol的混合气体中含有的分子总数是2×6.02×1023 |
| C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 |
| D.1.0 L 0.1 mol·L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |