高锰酸钾制氯气:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 地康法制氯气:4HCl+O2 2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl
2Cl2+2H2O 二氧锰制氯气:MnO2+4HCl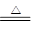 MnCl2+Cl2↑+2H2O 下列说法正确的是
MnCl2+Cl2↑+2H2O 下列说法正确的是
| A.实验室常用地康法制氯气 |
| B.氧化性强弱顺序是O2>KMnO4>MnO2 |
| C.氧化性强弱顺序是KMnO4>O2>MnO2 |
| D.氧化性强弱顺序是KMnO4>MnO2>O2 |
设NA表示阿伏加德罗常数,下列说法正确的是()
| A.在含有NA个CH3COO-的醋酸溶液中, H+ 数目略大于NA |
| B.在标准状况下,22.4LSO3的物质的量为1mol |
| C.2.9g熟石膏(2 CaSO4·H2O)含有的结晶水分子数为0.02NA |
| D.在标准状况下,2.24L的CCl4中含有C—Cl键的数目约为0.4NA |
实验室配制1mol·L-1盐酸250mL,下列不需用的仪器是()
| A.250 mL容量瓶 | B.托盘天平 | C.胶头滴管 | D.烧杯 |
下列叙述正确的是()
| A.一定温度、压强下,气体体积由其分子的大小决定 |
| B.一定温度、压强下,气体体积由其物质的量的多少决定 |
| C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L |
| D.不同的气体,若体积不等,则它们所含的分子数一定不等 |
用NA代表阿伏加德罗常数的值,下列有关说法正确的是()
| A.78g过氧化钠晶体中,含2NA个阴离子 |
| B.常温常压下,22.4L氦气含有NA个氦原子 |
| C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA |
| D.常温下16g O2与O3的混合气体中含氧原子数为NA |
分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是()
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
| A.①② | B.③④ | C.①③ | D.②④ |