氯气是一种重要的化工原料。某学习小组在实验室中利用如图所示装置制取氯气并探究其性质。

(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有 、 。
(2)装置A中盛有的试剂是: ,作用是:________________________。
(3)若D中品红溶液褪色,则B装置发生反应的离子方程式是: 。
(4)证明FeBr2与Cl2发生了(3)中氧化还原反应的实验方法是: (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO32-,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的,理由是: 。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a. 3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4 c.1 mol·L-1 BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量 (填序号),若溶液__________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量 (填序号),若溶液__________________(填现象),则假设2成立。
今有甲、乙、丙、丁四种元素,已知:甲元素是地壳中含量最高的元素;乙元素是金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色,氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名称和符号______________________
(2)写出上述元素两两化合生成的化合物的化学式_____________________________
将装有甲烷和氯气混合气体的三个集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生。
(1)①置于黑暗中:_____________________________________________;
②将点燃的镁条靠近集气瓶外壁:______________________________;
③放在有光线的房子里:_________________________________。
(2)甲烷和氯气发生的一系列反应都是__________(填反应类型)反应,请写出甲烷和氯气反应生成一氯甲烷的化学方程式:________________________________
下表为元素周期表的一部分,回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
Ⅶ |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
? |
? |
(1)写出元素符号:①__________,④__________,⑥__________,⑦__________。
(2)若用M代表碱金属元素,则其最高价氧化物对应的水化物的化学式为__________;若用X表示卤族元素,则其气态氢化物的分子式为________;元素②、⑧、?的气态氢化物的稳定性由强到弱的顺序为______________________________(填化学式)。
(3)在元素③与⑩中,化学性质较活泼的是________(填元素符号),写出用化学实验证明它较活泼的方法:__________________________________________。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题: (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是,A、B、C、D的第一电离能由小到大的顺序为。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是;
(3)A的最高价含氧酸根离子中,其中心原子采取杂化,D的低价氧化物分子的空间构型是。
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为;(每个球均表示1个原子)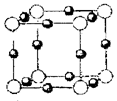
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为_________;Al与NaOH溶液反应的离子方程式为_____________.
(2) 的原子的中子数为_________;
的原子的中子数为_________;
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是__________。
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为__________________。