在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2g铁粉使其充分反应,下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
用下列实验装置进行的实验,能达到相应实验目的的是
| A.装置甲:防止铁钉生绣 | B.装置乙:除去乙烯中混有的乙炔 |
| C.装置丙:验证HCl气体在水中的溶解性 | D.装置丁:实验室制取乙酸乙酯 |
下列有关表述正确的是
⑴-OH 与 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
⑵sp2杂化轨道:
⑶Fe2+的离子结构示意图: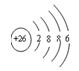
⑷CO2的分子模型示意图:
⑸丙烷的分子结构模型示意图:
⑹次氯酸的电子式为
⑺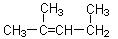 名称为1,3-二甲基―2―丁烯
名称为1,3-二甲基―2―丁烯
⑻熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4—
⑼乙炔的最简式 CH≡CH
| A.(1)(2)(4)(6) | B.(2)(3)(5) | C.(1)(4)(5)(8) | D.(1)(2)(5)(8) |
下列有关工业生产的叙述正确的是
| A.用明矾净水是因为Al3+水解生成Al(OH)3胶粒具有很强的吸附性 |
| B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率 |
| C.硫酸工业中,在接触室安装热交换器是为了利用硫铁矿燃烧时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
对于平衡体系2SO2(g) + O2(g)  2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
常见的晶体有如下类型:①分子晶体;②离子晶体;③原子晶体;④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是
| A.①②③④ | B.只有①③④ | C.只有①②③ | D.只有①③ |