W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

Ⅰ.(1)X位于元素周期表中的位置______________;W的基态原子核外有_________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 ____________。
Ⅱ.部分化学键的键能见下表:
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/ kJ•mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“”“”)SiC________Si;SiCl4________SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)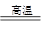 Si(s)+4HCl(g),
Si(s)+4HCl(g),
计算该反应的反应热△H=_________kJ·mol-1。
铁丝在氯气中点燃发生反应:2Fe + 3Cl2  2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被_________(填“氧化”或“还原”);Fe做_________剂,具有性。在该反应中,若消耗了1 mol Fe,则生成_______mol FeCl3,转移mol电子。
2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被_________(填“氧化”或“还原”);Fe做_________剂,具有性。在该反应中,若消耗了1 mol Fe,则生成_______mol FeCl3,转移mol电子。
对无机化合物可根据其组成和性质进行如下分类: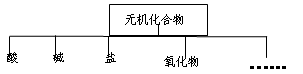
(1)上图所示的物质分类方法可称为。
(2)以Na、H、C、N、O、S、Cl等元素中任选两种或三种元素组成合适的一种物质,将其化学式分别填在下表中的相应位置。
| 物质 类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空(每空 1分,共计 10分)
(1)用量筒量取所需浓H2SO4的体积为mL;
(2)如果实验室有10mL、20mL、50mL量筒,应选用mL量筒,实验中还需要用到的仪器有、 、烧杯、玻璃棒。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
③容量瓶洗净后未干燥;
④摇匀后发现液面低于刻度线后加水至溶液的凹液面与刻度线相平;
⑤用量筒量取浓H2SO4时仰视刻度线:。
(4)若定容时液面高于刻度线应采取的措施是。
某工厂在山坡坑道的仓库里贮有氯气钢瓶。某天,有一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施,请选择填充并简述理由。(每空1分,共计5分)
(1)处理钢瓶的方法正确的是,
A、钢瓶推到坡下的小河里
B、把钢瓶丢到深坑里,用熟石灰填埋
C、把钢瓶扔到农田中;
简述理由
(2)钢瓶处理后,工人应立即,
A、转移到坡下 B、转移到坡上
简述理由
(3)若在场工人没有防毒面具,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,最适宜采用的物质是。
A、NaOH B、NaClC、Ca (OH)2D、Na2CO3
完成下列反应方程式(每空1分,共计3分)
(1)铁在氯气中燃烧:
(2)用氢氧化钠来吸收氯气尾气
(3)漂白粉的漂白原理: