某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是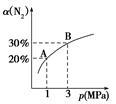
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
自然界中存在的碘的稳定性核素是碘-127(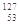 I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(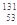 I)。碘-131 (
I)。碘-131 (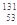 I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
A.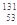 I是一种新元素 I是一种新元素 |
B.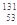 I的摩尔质量为131g I的摩尔质量为131g |
C.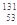 I和 I和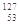 I互为同位素 I互为同位素 |
D.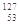 I中子数与质子数之差为74 I中子数与质子数之差为74 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A、X、Y元素的金属性X<Y
B、一定条件下,Z单质与W的常见单质直接生成ZW2
C、Y的最高价氧化物对应的水化物能溶于稀氨水
D、一定条件下,W单质可以将Z单质从其氢化物中置换出来
下列说法中正确的是
| A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
| B.含有共价键的物质一定是共价化合物 |
| C.HCl溶于水只需克服分子间作用力 |
| D.干冰升华时,分子内共价键会发生断裂 |
已知2SO2+O2 2SO3为放热反应,对该反应的下列说法中正确的是
2SO3为放热反应,对该反应的下列说法中正确的是
| A.O2的能量一定高于SO2的能量 |
| B.SO2和O2的总能量一定高于SO3的总能量 |
| C.SO2的能量一定高于SO3的能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是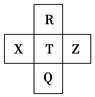
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.最高价氧化物的水化物的酸性:R>T |