向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5L |
0.5L |
1. 0L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5molA 0.5 molB |
1.5 molA 0.5 molB |
6.0 molA 2.0 molB |

下列说法正确的是
A.l0min内甲容器中反应的平均速率v(A)=0.025mol·(L·min)-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
下列电极反应正确的是
| A.用惰性电极电解饱和食盐水阳极反应式:2Cl-+ 2H+=H2↑+ Cl2↑ |
| B.碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
| D.铅蓄电池放电时的负极反应式为:Pb+SO42--2e-=PbSO4 |
关于铜电极的叙述中不正确的是
| A.铜锌原电池中铜是正极 |
| B.在镀件上镀铜时可用金属铜作阳极 |
| C.用电解法精炼铜时粗铜做阳极 |
| D.在电解饱和食盐水的装置可用铜做阳极,且电极产物是Cl2 |
下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是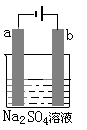
| A.a电极附近呈红色,b电极附近呈蓝色。 |
| B.a电极附近呈蓝色,b电极附近呈红色。 |
| C.逸出气体的体积,a电极的大于b电极的。 |
| D.a、b两电极都逸出无色无味气体。 |
有关下图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生。 |
| B.铜离子在铜片表面被还原。 |
| C.电流从锌片经导线流向铜片。 |
| D.反应中,盐桥中的K+会移向ZnSO4溶液。 |
下列有关金属腐蚀及其防护的叙述 中不正确的是
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用牺牲锌块的方法来保护船身 |
| C.用铜质铆钉铆接铁板,铁板不易被腐蚀 |
| D.浸泡在水中钢闸门,水面附近区域的腐蚀程度大于长期在水下的部分 |