运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
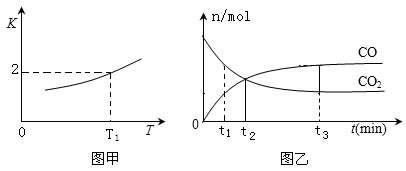
①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2molN2 |
3molH2 |
0molNH3 |
1.5molNH3 |
同种物质的体积分数相同 |
| 乙 |
amolN2 |
bmolH2 |
0molNH3 |
1.2molNH3 |
起始时乙容器中的压强是甲容器的____倍。
在1L盐酸酸化的AlCl3溶液中加入一定浓度的NaOH溶液,发现当加入amLNaOH溶液时开始出现沉淀,且当加入到bmL和 cmL时出现的沉淀一样多(c>b>a),试求当加入多少毫升NaOH溶液时,产生最大量的沉淀?
在500mLNaCl和NaBr的混合溶液中,加入200mL0.05ml/L的AgNO3溶液,生成1.326g沉淀;往滤液中加入过量盐酸,又得到0.287g沉淀。求原混合液中Cl- 和Br-的物质的量浓度。
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和 NO2混和气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为_________L,NO2的体积为____________L;
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_________mol/l;
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3, 至少需要30%的双氧水____________g。
(1)(4分)将100.0g Na2CO3和NaHCO3固体混合物充分加热,使产生的水蒸汽和CO2全部通入足量的Na2O2中充分反应,产生11.2L的气体(气体体积已转算成标准状况下体积),则混合物中Na2CO3质量分数是 。
(2)(10分)200 mL 2.00 mol/L的Al2(SO4)3溶液中含有 mol Al2(SO4)3, Al3+的物质的量浓度为 ,SO42-的物质的量浓度为 ,含Al3+的物质的量为 ,质量为 。
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比为多少?