石灰石常见的矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数(石灰石中所含的杂质既不溶于水也不与稀盐酸反应),取来了一些矿石样品,并取稀盐酸400 g,平均分成4份,进行实验,结果如下:
| 稀盐酸 |
第l份 |
第 2份 |
第 3份 |
第4份 |
| 加入石灰石样品的质量/g |
10 |
2O |
30 |
40 |
| 生成C02的质量/g |
3.52 |
7.04 |
8.8 |
m |
(1)上表中m的数值是 ;
(2)试计算这种石灰石矿中碳酸钙的质量分数。(写出计算过程)
根据下图某品牌化肥的广告标签,回答下列问题:
(1)碳酸氢铵(NH4HCO3)中,各元素的质量比为N : H : C : O = 。
(2)这袋化肥中NH4HCO3的质量分数为98%,小明通过计算发现该化肥的含氮元素的质量实际为________Kg,(保留一位小数),断定该广告为虚假广告。
如图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和。工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的。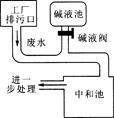
已知:中和50 mL废水需要l%NaOH溶液40 mL。试求:
废水中硫酸的质量分数。(假设废水和NaOH溶液的密度均为1 g·cm-3)
(1)在做体育训练拉单杠时,体育老师给小明使用了“镁粉”(如图),
碳酸镁的化学式为MgCO3,求碳酸镁的相对分子质量是,碳酸镁中镁元素、碳元素和氧元素质量比碳酸镁中镁元素的质量分数是________。(保留小数点后一位)
(2)8.8克二氧化碳中氧元素质量和多少克碳酸镁中氧元素相等?(列式求解)
工业上用电解氯化镁的方法生产金属镁,MgCl2==Mg+Cl2↑。问:电解950kg氯化镁至多能生产多少千克金属?同时能得到多少千克氯气?
3g碳在氧气中充分燃烧,可得到多少质量二氧化碳?