根据下表的信息判断,下列说法错误的是
| 序号 |
反应物 |
产物 |
| ① |
Cl2 、 H2O2 |
Cl- |
| ② |
Cl2、FeI2 |
FeCl2、I2 |
| ③ |
KClO3、HCl |
Cl2、KCl 、H2O |
A.第①组反应的氧化产物为O2
B.第②组反应中Cl2和FeI2的物质的量之比小于或等于1:1
C.第③组反应中生成1molCl2转移6mol电子
D.氧化性由强到弱的顺序为ClO3->Cl2 >I2
有人设想将不溶的碳酸盐材料通过特殊的加工方法使之变为纳米碳酸盐材料(即碳酸盐材料粒子直径是纳米级),这将使建筑材料的性能发生巨大变化,下列关于纳米碳酸盐材料的推测正确的是( )
A.纳米碳酸盐材料是与胶体相似的分散系
B.纳米碳酸盐材料分散到水中会产生丁达尔效应
C纳米碳酸盐材料的化学性质已与原来的碳酸盐材料完全不同
D.纳米碳酸盐材料的粒子不能透过滤纸
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是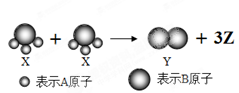
| A.根据质量守恒定律可推知,1个Z分子中含有2个A原子 |
| B.该反应属于分解反应 |
| C.该反应属于氧化还原反应 |
| D.X、Y、Z三种物质均属于非电解质 |
在两个密闭的容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
A.甲的分子数比乙的分子数多 B .甲的物质的量比乙的物质的量少[
.甲的物质的量比乙的物质的量少[
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
下列说法正确的是()
| A.80g SO3在标准状况下的体积为22.4 L |
| B.22.4 L O2中约含有6.02×1023个氧分子 |
| C.在标准状况下,20 mL NH3和60 mL N2所含的分子个数之比为1:3 |
| D.将80 g NaOH溶于1 L水中,所得溶质的物质的量浓度为2 mol/L |
提纯含有少量硝酸钡杂质的硝酸钾溶 液,可以使用的方法是()
液,可以使用的方法是()
| A.加入过量的碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
B. 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量的碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |