欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑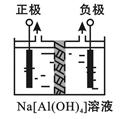
(1)产物Al(OH)3在区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是。
(5)往溶液中加入H2O2的作用是(用离子方程式表示)。
(6)加入的X试剂(填选项编号)是。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是。
选做【化学——有机化学基础】(12分)枯茗醛可用作食用香精。现由枯茗醛合成兔耳草醛,其合成路线如下:
已知醛在一定条件下发生如下反应:
请回答下列问题:
(1)写出试剂X的结构简式:____________。
(2)写出有机物B中所含官能团的名称为_____________;A→B的反应类型为__________。
(3)检验B中的官能团所需的试剂是_________(填序号)。
| A.银氨溶液 稀盐酸 溴水 |
| B.新制氢氧化铜悬浊液稀硫酸酸性高锰酸钾溶液 |
| C.新制氢氧化铜悬浊液 稀盐酸 溴水 |
| D.银氨溶液稀硫酸酸性高锰酸钾溶液 |
(4)写出有机物C生成兔耳草醛的化学方程式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的苯环上只存在一种化学环境的氢原子;
写出Y可能的结构简式:_____________、______________。
选做【化学——物质结构与性质】(12分)
(1)X难溶于水、易溶于有机溶剂,其晶体类型为___________;Cu2+的核外电子排布式为__________。
(2)M中所含元素的电负性由大到小顺序为_______,N原子以___________轨道与O原子形成 键。
键。
(3)上述反应中断裂和生成的化学键有___________(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)铜晶胞的结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
(18分)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
则反应a的平衡常数表达式为_________;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是压缩注射器 |
B.c点与a点相比, 增大, 增大, 减小 减小 |
| C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc |
D.d点: (正)> (正)>  (逆) (逆) |
(3)利用反应 构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为__________极,其电极反应式为_________________。
②当有2.24LNO2(标准状况下)被处理时,转移电子为____________mol。
③为使电池持续放电,该离子交换膜需选用____________交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式_______________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有____________(任写一种)。
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图 。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示).
(3)BD 中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
(4)1mol B一中含有 键的数目为 NA。
键的数目为 NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 .
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示)。