含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(
提示:离子沉淀(或沉淀溶解)pH见下表
| 离子 |
Mg2+ |
Al 3+ |
物质 |
Al(OH)3 |
| 开始沉淀pH |
8.93 |
3.56 |
开始溶解pH |
8.04 |
| 完全沉淀pH |
10.92 |
4.89 |
完全溶解pH |
12.04 |

高温下硫酸亚铁发生如下反应:2FeSO4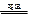 Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是( )
Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是( )





| A.BaSO3和BaSO4 | B.BaS |
C.BaSO3 | D.BaSO4 |
实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表
明粉末中K和S元素的质量比为39∶16,下列结论正确的是()
A.根据元素分析结果推测该粉末为纯净物 |
B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 |
C.将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 |
D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成 ,证明原粉末是K2SO4和K2SO3的混合物 |
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下: ①SO2+N2O5
①SO2+N2O5 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2 NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是()
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是()
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
B.硫化氢通入浓H2SO4 |
C.浓H2SO4滴入萤石中,加热 |
D.加入少量的H2SO4使乙酸乙酯水解 |
导致下列现象的主要原因,与排放SO2有关的是()
| A.酸雨 | B.光化学烟雾 |
C.臭氧空洞 | D.温室效应 |
下列关于硒的叙述中,不正确的是()
A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se |
B.硒化氢有恶臭味,有毒,比硫化氢易分解 |
C.硒化氢在空气中不能燃烧 |
D.亚硒酸(H2SeO3)是一种弱酸 |