下列自发反应可用能量判据来解释的是
| A.2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol |
| B.2N2O5(g)=4NO2(g)+O2(g)ΔH=+56.7kJ/mol |
| C.(NH4)2CO3(s) =NH4HCO3(s)+NH3(g) ΔH =+74.9kJ/mol |
| D.硝酸铵自发地溶于水 |
下列物质的分离、提纯和鉴别的方法中(必要时可加热),可行的是
| A.以AgNO3溶液和稀盐酸检验溶液中是否含有Cl- |
| B.用升华法分离碘和氯化铵的混合物 |
| C.以粗铜为阴极,精铜为阳极,CuSO4溶液为电解液,精炼铜 |
| D.用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+ |
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系
| A.c(NH4+)<c(Cl-) | B.c(NH4+)=c(Cl-) |
| C.c(NH4+)>c(Cl-) | D.无法确定c(NH4+)与c(Cl-) |
设C+CO2 2CO-Q1(吸热反应)反应速率为u1,N2+3H2
2CO-Q1(吸热反应)反应速率为u1,N2+3H2 2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
可以充分说明反应P(g)+Q(g)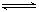 R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是
| 选项 |
陈述I |
陈述II |
判断 |
| A |
用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 |
可以制取更多的氢气 |
I对、II对、有 |
| B |
用Mg—Al—NaOH构成原电池 |
Mg更活泼作负极 |
I对、II对、无 |
| C |
AlCl3是离子化合物 |
电解熔融的AlCl3制取金属铝 |
I对、II对、无 |
| D |
石墨常用做电解池的电极 |
石墨的化学性质稳定且导电性好 |
I对、II对、有 |