室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
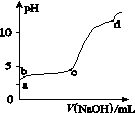
A.a点时溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH- Al(OH)3 Al(OH)3 |
| B.a~b段,溶液pH增大,Al3+浓度不变 |
| C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
下列分子或离子的空间构型为平面三角形的是( )
| A.NO | B.NH3 | C.H3O+ | D.CO2 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ()
| A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
| A.直线形;三角锥型 | B.V形;三角锥型 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
下列说法不正确的是 ( )
| A.σ键比π键重叠程度大形成的共价键强 |
| B.两原子形成共价键时最多有一个σ键 |
| C.气体单质中,一定有σ键,可能有π键 |
| D.N2分子中有一个σ键,2个π键 |
下列既有极性键,又有非极性键的非极性分子是 ()
| A.二氧化硫 | B.四氯化碳 | C.过氧化氢 | D.乙炔 |