H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中( )
H++S2-。若向H2S溶液中( )
| A.加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A.使酚酞试液变红的溶液: Na+、Cl—、SO42—、Fe3+ |
| B.由水电离的c(H+)=10-12 mol·L—1的溶液:K+、Ba2+、Cl—、Br— |
| C.在pH = 1溶液中:NH4+、Fe2+、NO3—、Cl— |
| D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
关于小苏打水溶液的表述正确的是()
| A.c (Na+)="c" (HCO3-) + c (CO32-) + 2c (H2CO3) |
| B.c (Na+) + c (H+) =" c" (HCO3-) + 2c (CO32-) +c (OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离有:NaHCO3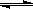 Na++HCO3—,HCO3— Na++HCO3—,HCO3—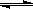 H++CO32—,H2O H++CO32—,H2O 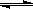 H++OH— H++OH— |
相同温度下,100mL 0.01 mol·L-1的醋酸溶液与10mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是()
| A.中和时所需NaOH的量 | B.c(H+) |
| C.c(OH-) | D.c(CH3COOH) |
常温下,取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的PH等于12,则原溶液的浓度为()
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |
某温度下,已知反应mX(g)+ nY(g) 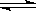 qZ(g)△H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是()
qZ(g)△H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是()
| A.反应速率υ正(X) =(n/m)υ逆(Y) | B.加入X,反应的△H增大 |
| C.增加Y的物质的量,X的转化率增大 | D.降低温度,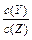 的值变小 的值变小 |