为了检验糖尿病病人的尿液中是否含有葡萄糖,并判断病情轻重,应选用下列试剂中的(填序号),进行的操作是________(填序号),并根据病情的轻重(任选一种),在结论中用不同数目的“+”号表示。
| 试剂 |
操作步骤 |
发生现象 |
结论 |
| ①氢氧化铜 |
A.将尿液与试剂混合振荡 |
甲.蓝色溶液 |
|
| 乙.生成绿色沉淀 |
|
||
| ②斐林试剂 |
B.将尿液与试剂混合后加热至沸腾 |
丙.生成黄绿色沉淀 |
|
| ③硫酸铜 |
C.将尿液与试剂混合后微热 |
丁.生成黄色沉淀 |
|
| 戊.生成砖红色沉淀 |
|
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H=kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
①X是(填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃)K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为。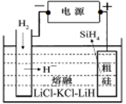
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为。
(2)步骤④中加入的指示剂为。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为。
②BH—4的空间构型是(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是(多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: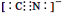
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。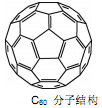
①C60晶体易溶于苯、CS2,说明C60是分子(选填:“极性”、“非极性”);
②1mol C60分子中,含有σ键数目为。
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]。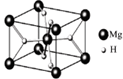
利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]及硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: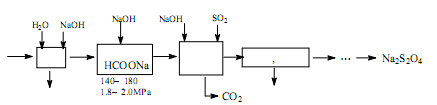
(1)转炉炼钢时,存在反应: ,其平衡常数表达式为K=。
,其平衡常数表达式为K=。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是。
(3)从滤液中回收甲醇的操作方法是;还可回收的盐类物质是(只写一种化学式)。
(4)合成保险粉反应的化学方程式为。
(5)保险粉、H2O2均可用于纸桨漂白剂,写出保险粉与过量的H2O2在水溶液中反应生成硫酸盐等物质的离子方程式。
我校化学兴趣小组的学生对某品牌的消毒液的成分和性质进行实验探究:
①该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸);
②用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色;
③取适量消毒液,滴加稀硫酸后,有黄绿色气体生成;
④用洁净铂丝蘸取消毒液,在无色灯焰上灼烧,火焰呈黄色。
⑤取适量消毒液,通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。
请回答以下问题:
(1)该消毒液的主要成分是_______________________________________。
(2)pH试纸颜色的变化说明消毒液溶液具有的性质是 _________________。
(3)实验③中的离子方程式为_______________________________________。
(4)实验⑤中,有“浅黄色沉淀”生成时的离子方程式为_________________________,又“澄清”时的离子方程式为__________________________________________。