化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)
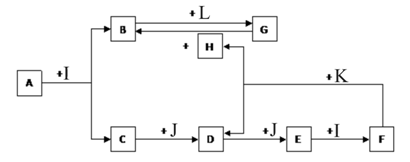
(1)写出下列物质的化学式:E J
(2)写出D通入足量稀Ba(NO3)2溶液反应的化学方程式:_______________________
(3)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在Al制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,写出该反应的离子方程式_____________
(4)A电池性能优越,A-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2A+3AgO+2NaOH=2NaAO2+3Ag+H2O,下列说法正确的是
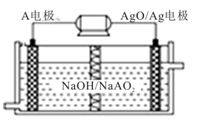
A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。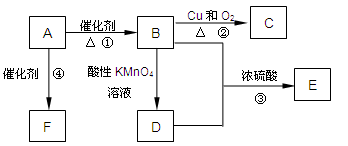
(1)A的结构式为__________,C的名称为__________。
(2)B分子中的官能团名称是_________,请设计一种验证B物质存在该官能团的方法__________________。
(3)写出下列反应的化学方程式并指出反应类型:
①__________________________________________;反应类型是_____________;
④__________________________________________;反应类型是_____________。
石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。(每空2分)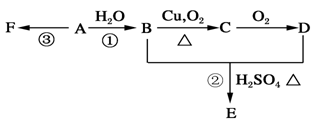
(1)A的分子式为________________。
(2)写出:反应①的化学方程式:;该反应的类型是_______________。反应③的化学方程式:____________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:______________。
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为____________;A与该烃的体积比为_____________。
在一定条件下可实现下图所示物质之间的转化: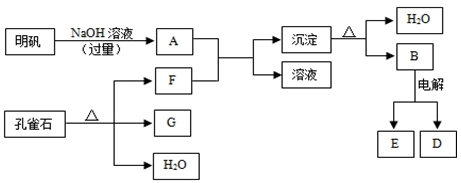
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:。
(3)写出B电解生成E和D的反应方程式:。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式,该反应消耗了2 molG,则转移的电子数是。
聚己二酸丙二醇酯是性能很好的耐热性和耐久性增塑剂。其中一种合成路线如下:
已知:①烃A的相对分子质量为84,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为一氯代烃;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④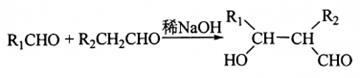 。
。
回答下列问题:
(1)A的结构简式为。
(2)由B生成C的化学方程式为。
(3)由E和F生成G的反应类型为,G的化学名称为 。
(4)①由D和H生成聚已二酸丙二醇酯的化学方程式为。
②若聚已二酸丙二醇酯平均相对分子质量为5600,则其平均聚合度约为(填标号)
a.30 b.35 c.40d.48
(5)D的同分异构体中能同时满足下列条件的共有种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体②既能发生银镜反应,又能发生水解反应。其中核磁共振氢谱显示为4组峰,且峰面积比为6:1:1:2的是(写出其中一种结构简式)。
(6)请设计以甲苯、乙醛为有机原料(其他无机原料任选)合成肉桂酸(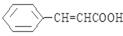 )的合成路线示意图。
)的合成路线示意图。
已知: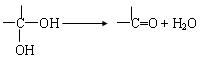
示例: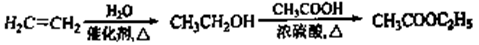
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:a.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。b.反应①②是化工生产中的重要反应。c.化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。d.化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。e.化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)A元素在元素周期表中的位置____________________。
(2)反应③的化学方程式:________________________。
(3)C的结构式:________;
F的一种用途:_________________________。
(4)L的溶液与化合物E反应的离子方程式:_________ 。
(5)化合物J的化学式: ________________________。