在①CH2==CH2,② ,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是___________;
(2)属于高分子化合物的是___________;
(3)能与Na2CO3溶液反应的是___________;
(4)能发生酯化反应的是___________;
(5)既能发生取代反应又能发生加成反应的是________________。
(1)
为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ 除杂实验 |
Ⅱ 试剂 |
Ⅲ 操作方法 |
答案 |
||
| Ⅰ |
Ⅱ |
Ⅲ |
|||
| ①苯(苯酚) |
A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
a.蒸馏 b.分液 c.盐析、过滤 |
① |
||
| ②乙醇(水) |
② |
||||
| ③肥皂(甘油、水) |
③ |
||||
| ④乙酸乙酯(乙酸) |
④ |
(2)现有以下有机物:(用序号回答下列各问)
① 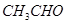 ②
② 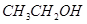 ③
③ 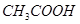 ④
④ 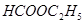
①能与 溶液反应的有_________________;
溶液反应的有_________________;
②能与银氨溶液反应产生银镜的是____________________;
③既能发生消去反应,又能发生酯化反应的有___________________;
④核磁共振氢谱图中有3个吸收峰,面积比为3:2:1的是___________;
(3)a.在洁净的试管中加入少量硝酸银溶液,再逐滴滴加稀氨水,现象是生成白色沉淀,反应的离子方程式是①_______________________ ;继续滴加至沉淀恰好溶解,即得银氨溶液;b. 向a中所得的银氨溶液中滴入少量葡萄糖溶液,混合均匀后,放在水浴中加热3min~5min,即可在试管内壁上形成银镜,则此反应的化学方程式为②(葡萄糖的结构简式用G-CHO表示):。
| A |
|||||||||||||||||
| B |
C |
||||||||||||||||
(1)元素A的名称是, 位于第周期,第族,原子结构示意图为。
(2)在我们常用的周期表中,氢元素的位置比较尴尬,它是第1列的唯一非金属元素。请写出H2O的电子式:,氢还能与许多金属形成金属氢化物比如NaH,试分析其中氢元素的化合价为,这样看来若把氢元素放在 族也有一定道理。
(3)元素B与元素C形成的化合物中,化学键类型为。
(4)A、B、C的原子半径由大到小的顺序为(用元素符号回答)。
化学概念中有不少带“同”字的,比如:①同位素②同素异形体③同分异构体④同系物⑤同种物质,请分别说出下面各物质的对应关系(用上面序号作答)
(1)金刚石和石墨(2)1H和2H.
(3)甲烷和正丁烷(4)乙醇和二甲醚.
(5)干冰和二氧化碳.
Ⅰ.写出下列官能团的名称(各2分,共6分)
(1) (2)
(2) (3)
(3) 
Ⅱ.写出下列反应的化学方程式(不可写离子方程式)(各2分,共6分):
(1)葡萄糖溶液和新制氢氧化铜悬浊液(含氢氧化钠)加热反应;
(2)2-溴丙烷和NaOH乙醇溶液共热;
(3)少量高锰酸钾酸性溶液和乙醇混合加热反应褪色同时有乙酸和硫酸锰生成;
X、Y和W为原子序数依次递增的短周期元素。已知:X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铜粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒(催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是(填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |