在理论上不能用于设计原电池的化学反应是
| A.Al(OH)3(s)+NaOH(aq)=NaAlO2(aq)+2H2O(l) ΔH<0 |
B.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(l) ΔH<0 2CO2(g)+3H2O(l) ΔH<0 |
| C.CO2(g)+C(s)=2CO(g) ΔH>0 |
| D.H2(g)+Cl2(g)=2HCl(g) ΔH<0 |
导致下列环境问题的主要原因与排放SO2有关的是
| A.酸雨 | B.光化学烟雾 |
| C.臭氧层空洞 | D.温室效应 |
乙炔是有机合成工业的一种原料。工业上曾用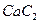 与水反应生成乙炔。
与水反应生成乙炔。
(1)将乙炔通入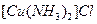 溶液生成
溶液生成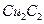 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为。
基态核外电子排布式为。
(2) Ca2+的原子结构示意图:;已知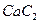 中
中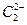 与
与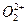 互为等电子体,
互为等电子体,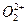 的电子式可表示为;1mol
的电子式可表示为;1mol 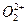 中含有的
中含有的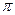 键数目为。
键数目为。
(3)乙炔与氢氰酸反应可得丙烯腈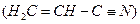 。丙烯腈分子中碳原子轨道杂化类型
。丙烯腈分子中碳原子轨道杂化类型 是;分子中处于同一直线上的原子数目最多为。
是;分子中处于同一直线上的原子数目最多为。
(4)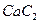 晶体的晶胞结构与
晶体的晶胞结构与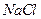 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但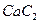 晶体中含有的哑铃形
晶体中含有的哑铃形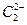 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。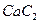 晶体中1个
晶体中1个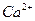 周围距离最近的
周围距离最近的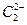 数目为。
数目为。
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一 处新建一座硫酸厂,你认为厂址宜选在的郊区(填选项的标号)
处新建一座硫酸厂,你认为厂址宜选在的郊区(填选项的标号)
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g) ⇌SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因。
阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有性,铁离子具有性,第二则则信息中CO2是剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2→ __Na2FeO4+ __NaNO3 + __NaCl + __H2O
①配平上述反应,并分析 元素被氧化,当生成3mol还原产物时,转移电子的总数为;
元素被氧化,当生成3mol还原产物时,转移电子的总数为;
②铁酸钠除 了能消毒外,还可以用于净水,原因是。
了能消毒外,还可以用于净水,原因是。
下列离子方程式正确的是()
| A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+3NO2=2NO3-+NO↑+H2O |
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合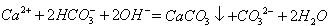 |
| C.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
D.苯酚与碳酸钠溶液的反应: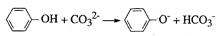 |