高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:湿法制备的主要离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,干法制备的主要反应方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。则下列有关说法不正确的是( )
| A.高铁酸钠中铁显+6价 |
| B.湿法中FeO42-是氧化产物 |
| C.干法中每生成1 mol Na2FeO4转移4 mol电子 |
| D.Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
在抢救大出血的病危病人时,常需静脉点滴0.9%氯化钠溶液(从俗称“生理盐水’’),是由于人体血液的“矿化度”(即无机盐的含量)为0.9%。另有研究表明,30亿年前地表原始海水的“矿化度”即为0.9%。对此,下列猜测或评论中不足取的是()
| A.人体血液和原始海水的“矿化度”都为0.9%纯属巧合 |
| B.人类祖先可能是从原始海洋逐渐进化到陆地上来的 |
| C.人体血液和原始海水之间存在着某种尚未认识的关系 |
| D.人体血液仍然带有原始海水的某些印痕 |
近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是()
| A.硫化氢分子很稳定,受热难分解 |
| B.硫化氢分子中所有原子的最外电子层都达到8电子结构 |
| C.将硫化氢通入溴水,溴水褪色 |
| D.硫化氢是电解质,其电离方程式是:H2S==2H++S2— |
2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物。下列关于碳氢化合物的叙述正确的是()
| A.石油的主要成分是碳氢化合物 | B.乙炔是含碳量最高的碳氢化合物 |
| C.碳氢化合物的通式为CnH2n+2 | D.碳氢化合物中的化学键都是极性键 |
人造骨是一种具有生物功能的新型无机非金属材料,它类似于人骨和天然牙的性质和结构,可以依靠人体体液中补充某些离子形成新骨,在骨骼接合界面发生分解、吸收、析出等反应,实现骨骼牢固结合。人造骨植入人体内形成新骨需吸收人体中的()
| A.Na+、CO32— | B.K+、Cl- | C.Fe3+、NO3- | D.Ca2+、PO43- |
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:() ①CaBr2+H2O
①CaBr2+H2O  CaO+2HBr ②2HBr+Hg HgBr2+H2↑
CaO+2HBr ②2HBr+Hg HgBr2+H2↑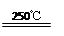 ③HgBr2+CaO HgO+CaBr2 ④2HgO
③HgBr2+CaO HgO+CaBr2 ④2HgO 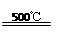 2Hg+O2↑
2Hg+O2↑
该方案的目的是为了制备
| A.HBr | B.CaO | C.H2 | D.Hg |