下列各项内容中排列顺序正确的是
| A.相同物质的量浓度的下列溶液中NH4+的浓度: (NH4)2SO4> NH4Cl > NH4HCO3 |
| B.微粒半径: K+ > S2-> F- |
| C.给出质子的能力:CH3COOH >C2H5OH > H2O |
| D.氢化物的沸点: HF > HCl > HBr |
室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了30 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL ,则该气态烃的分子式为
| A.C4H6 | B.C2H4 | C.C3H8 | D.C4H8 |
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
| A.V1>V2>V3 | B.V1>V3>V2 |
| C.V2>V3>V1 | D.V3>V1>V2 |
下图为两个原电池装置图,由此判断下列说法错误的是
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
某有机物X的结构简式如图所示,则下列有关说法中正确的是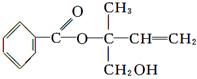
| A.X的分子式为C12H16O3 |
| B.可用酸性高锰酸钾溶液区分苯和X |
| C.X在一定条件下能发生加成、加聚、取代、消去等反应 |
| D.在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g),反应过程如图:
2NH3(g),反应过程如图:
下列说法正确的是
| A.t1 min时正逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0 min~8 min,H2的平均反应速率v(H2)="0.75" mol·L-1·min-1 |
| D.10 min~12 min,N2的平均反应速率v(N2)="0.25" mol·L-1·min-1 |