下列水溶液一定呈中性的是( )
| A.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 |
| B.c(H+)=1.0×10-7mol•L-1的溶液 |
| C.pH=7的溶液 |
| D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
用惰性电极电解饱和食盐水,当电源供给0.2 mol电子时,停止通电。若此溶液体积为2 L,则所得电解液的pH是( )
| A.1 | B.8 |
| C.13 | D.14 |
家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物,通电时,电解槽里的极板上产生大量气泡。切断电源后所得消毒液具有强烈的杀菌能力,且对人体无害。与该发生器有关的反应是(双选)( )
| A.2NaCl+2H2O通电2NaOH+H2↑+Cl2↑ |
| B.H2+Cl2===2HCl |
| C.Cl2+2NaOH===NaCl+NaClO+H2O |
| D.NaClO+HCl===NaCl+HClO |
在水中加入等物质的量的Ag+、Pb2+、Na+、 、
、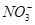 、Cl-,该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量之比为( )
、Cl-,该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量之比为( )
| A.35.5∶108 | B.16∶207 |
| C.8∶1 | D.108∶35.5 |
电解饱和食盐水两电极上产生气体的体积比应是1∶1,但实际测量时却发现V(H2)>V(Cl2)(常温常压),其原因可能是( )
| A.H2的摩尔质量比Cl2的小 |
| B.Cl2有刺激性气味 |
| C.H2的熔、沸点比Cl2的低 |
| D.H2的溶解度比Cl2的小 |
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |