在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp |
1.8×10-10 |
8.51×10-16 |
6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
对于达到平衡的可逆反应:X+Y W+Z,其他条件不变时,增大压强,正、逆反应速率变化的情况如图所示。
W+Z,其他条件不变时,增大压强,正、逆反应速率变化的情况如图所示。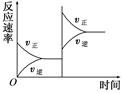
下列对X、Y、W、Z四种物质状态的描述正确的是
| A.W、Z均为气体,X、Y中只有一种为气体 |
| B.X、Y均为气体,W、Z中只有一种为气体 |
| C.X、Y或W、Z中均只有一种为气体 |
| D.X、Y均为气体,W、Z均为液体或固体 |
下图的曲线是800 ℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,
能以此曲线表示的反应是
A.2A B+3C B.B+3C
B+3C B.B+3C 2A
2A
C.A+C B D.B
B D.B A+C
A+C
下列可逆反应达到平衡后,增大压强同时降低温度,平衡一定向右移动的是
A.2AB(g)  A2(g)+B2(g) ΔH>0 A2(g)+B2(g) ΔH>0 |
B.A2(g)+3B2(g)  2AB3(g) ΔH<0 2AB3(g) ΔH<0 |
C.A(s)+B(g)  C(g)+D(g) ΔH>0 C(g)+D(g) ΔH>0 |
D.2A(g)+B(g)  3C(g)+D(s) ΔH<0 3C(g)+D(s) ΔH<0 |
已知:C+CO2 2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是
2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是
| A.升温 | B.加压 | C.降温 | D.使用催化剂 |
在一定条件下,可逆反应:A(g)+3B(g)  4C(g)达到平衡时,下列叙述正确的是
4C(g)达到平衡时,下列叙述正确的是
A.此时反应物B全部转化成了生成物
B.单位时间内生成n mol A,同时生成4n mol C
C.若改变条件,A、B、C的浓度不可能再变化
D.A、B、C的分子数比为1∶3∶4