设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.128gC60中含有90NA个分子 |
| B.46g NO2和N2O4的混合气体含有的原子数为3NA |
| C.标准状况下,22.4L CCl4所含的分子数为6.02×1023 |
| D.100mL0.1 mol·L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol·L-1 |
Nomex纤维是一种新型阻燃性纤维,它可由间苯二甲酸和间苯二胺(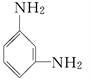 )在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )
)在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )
A.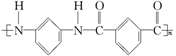 |
B.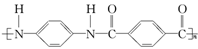 |
C.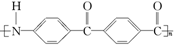 |
D.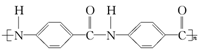 |
下列物质能够自身聚合成高分子化合物的是( )
| A.CH3CH2OH | B.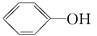 |
C.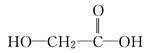 |
D.CH3COOH |
某高聚物的结构片段如下: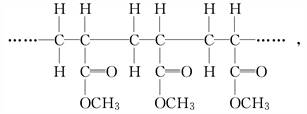
下列分析正确的是( )
| A.它是缩聚反应的产物 |
| B.其单体是CH2===CH2和HCOOCH3 |
| C.其链节是CH3CH2COOCH3 |
| D.其单体是CH2===CHCOOCH3 |
某高分子化合物的部分结构如下: 下列说法中正确的是( )
下列说法中正确的是( )
| A.若n为聚合度,则该物质的相对分子质量为97n |
B.该聚合物的链节是 |
| C.该聚合物的化学式为(C3H3Cl3)n |
| D.单体是CH2===CHCl |
生成高聚物 的单体有( )
的单体有( )
| A.1种 | B.2种 |
| C.3种 | D.4种 |