氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为___________ 。
又已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如下图一所示。

图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间
是 。
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应
的平衡常数为 。
③氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对于反应:N2O4(g) 2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
分数随压强变化曲线如下图二所示。

下列说法正确的是 。
a.A、C两点的反应速率:A﹤C
b.A、C两点的气体颜色:A浅,C深
c.B、C两点的气体平均相对分子质量:B﹤C
d.A、C两点的化学平衡常数:A﹥C
e.由状态B到状态A,可以用加热的方法
I、金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式、;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③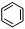
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiOFeO
(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;
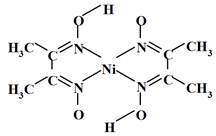
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。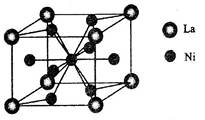
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。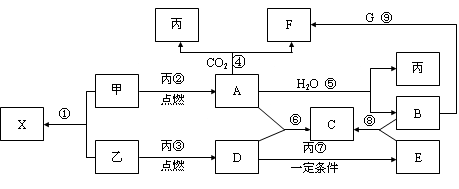
请回答:
(1)写化学式:丙_________,E________。
(2) X的电子式为____________________。
(3)写出A与H2O反应的化学反应方程式:_______________________________,反应中氧化剂是__________,1molA参加反应转移电子_____mol。
(4)写出反应⑨的离子方程式:________________________。
(5)物质F的俗名是__________或_________,其溶液显_____性,原因是_______________________________(用一个离子方程式表示)
臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,同时产生O2,则:
(1)该反应的化学方程式为:;
(2)该反应中氧化剂的名称为,还原产物的化学式为;
(3)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为__________________。
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):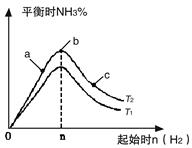
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):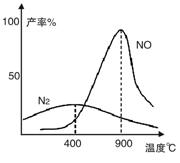
4NH3+5O2 4NO+6H2O 4NH3+3O2
4NO+6H2O 4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是___________________
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。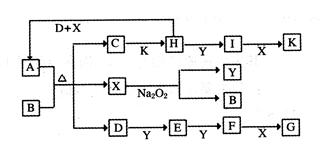
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。