框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体.L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)含碳量在0.03%~2%之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)K与氨水反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。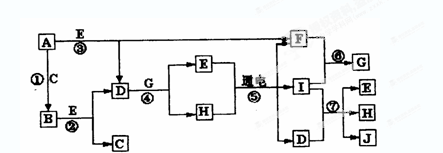
回答下列问题:
(1)B的化学式:。
(2)写出反应⑦的离子方程式。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在(填“阴、阳”)极附近溶液由无色变为红色,其原因是。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: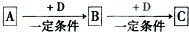
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)。
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为__。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,写出水溶液中A与B发生的反应的方程式。
【化学——有机化学基础】
某课题组拟采用苯酚和化合物B为主要物质合成有机中间体M(C16H14O4)。
已知:
I.R—COOH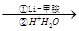 R—CHO;
R—CHO;
Ⅱ.经红外光谱检测研究确认,有机物M含有2个“C—O—C”结构。且lmol M与足量的银氨溶液反应能生成4molAg。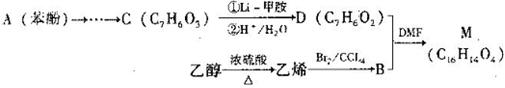
(1)利用乙醇制备乙烯的过程中,浓H2SO4的作用是。
(2)①有机物B中含有的官能团名称是。
②有机物B在X溶液作用下可生成乙二醇,则X为(填化学式)。
(3)有机物C分子苯环上有两个对位的取代基,写出有机物C的结构简式。
(4)①有机物D中不能发生的反应类型是(选填序号,下同)。
a.取代反应 b.消去反应 c.加成反应 d.氧化反应
②有机物Y与D互为同分异构体,写出符合下列条件的Y的结构简式。
i.含有苯环,苯环上的一卤代物有3种同分异构体
ⅱ.能与新制的氢氧化铜悬浊液反应产生砖红色沉淀
ⅲ.1molY最多能与2mol NaOH溶液反应
(5)下列关于有机物M的说法正确的是。
a.能发生还原反应 b.M是高分子化合物
c.能使酸性KMnO4溶液褪色 d.可与FeCl3溶液发生显色反应
e.能与浓溴水发生化学反应,生成白色沉淀
(6)写出由有机物B与有机物D合成M的化学方程式。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E溶液是无色的。请回答: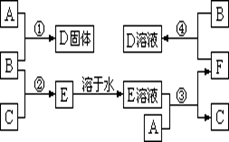
(1)A是__________,B是__________,C是__________(请填写化学式);
(2)反应①的化学方程式;
(3)反应③的离子方程式;
(4)反应④的离子方程式。
【化学—有机化学基础】(13分)
聚甲基丙烯酸酯纤维具有质轻、频率宽等特性,广泛应用于制作光导纤维。已知A为某种聚甲基丙烯酸酯纤维的单体,其转化关系如下: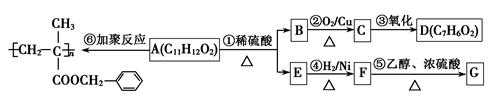
(1)D含有的含氧官能团的名称是______。
(2)⑤的反应类型是____________。
(3)根据系统命名法,F的名称是_____________。
(4)E不能发生的反应是(填写字母标号)
| A.能使酸性高锰酸钾溶液褪色 | B.能使溴的CCl4溶液褪色 |
| C.一定条件下,能够发生消去反应 | D.一定条件下,能够发生取代反应 |
(5)F的同分异构体中,属于酯类的有____________种。
(6)G的结构简式为。
(7)一定条件下,E可以发生加聚反应,化学方程式为。