一定能在下列溶液中大量共存的离子组是
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.强碱性溶液:Na+、HCO3-、NO3-、SO42- |
| C.遇酚酞变红的溶液中:K+、Na+、NH4+、Br- |
| D.强酸性溶液:Na+、NH4+、SO42-、Cl- |
在2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O的反应中,氧化剂和还原剂的物质的量之比为
| A.1∶8 | B.8∶1 | C.1∶5 | D.5∶1 |
实验室配制1mol·L-1盐酸250mL,下列不需用的仪是:
| A.250ml容量瓶 | B.托盘天平 | C.胶头滴管 | D.烧杯 |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.1.7g H2O2中含有的电子数为0.9 NA |
| C.1mol Na2O2固体中含离子总数为4 NA |
| D.标准状况下,2.24L戊烷所含分子数为0.1 NA |
下列各组离子在无色透明溶液中能大量共存的是
A.K+、HCO 、I-、Na+ 、I-、Na+ |
B.H+、Br-、NO 、Ag+ 、Ag+ |
C.Na+、MnO 、SO 、SO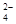 、K+ 、K+ |
D.Na+、CO 、Cl-、H+ 、Cl-、H+ |
相同物质的量浓度的盐酸、硫酸、磷酸分别和同物质的量浓度同体积的氢氧化钾溶液反应生成钾盐,需要三种酸的体积比为
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.6∶3∶2 |