短周期主族元素X 、Y 、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法正确的是( )
| A.简单离子半径大小顺序:rW>rZ>rY |
| B.元素W的氧化物对应水化物的酸性比Y 的强 |
| C.X与Y形成的原子晶体X3Y4的熔点可能比金刚石高 |
| D.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是( )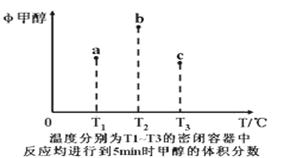
| A.该反应的正反应的△H>0 |
| B.反应进行到5min时,a容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
| A.Ba(OH)2、 Na2SO3、FeCl3、KCl | B.NaHCO3、Na2CO3、KNO3、NH4Cl、 |
| C.HCl 、CH3COOH、C2H5OH、Na2S | D.NH3·H2O、Na2SO4、NaHSO3、NaHSO4 |
下列说法不正确的是( )
| A.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| B.25 ℃与60 ℃时,0.005 mol/L的硫酸溶液pH相等 |
| C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等 |
| D.常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH≈7 |
在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是()
| A.加少量盐酸 | B.加少量NaOH晶体 | C.加少量醋酸钠晶体 | D.加热 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是()
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是()
| A.a>b | B.平衡向正反应方向移动 |
| C.A的转化率减小 | D.B的质量分数减小 |