在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)  2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
| A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III) |
| B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III) |
| C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) |
| D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
下列有关化学用语使用正确的是:()
A.CH4分子的比例模型: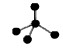 |
B.NH4Cl的电子式: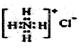 |
C.硫离子的离子结构示意图: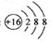 |
D.D聚丙烯的结构简式为: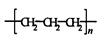 |
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g)  mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是()
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是()
A.A、B均转化了20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
在一定温度下,固定体积的密闭容器内,反应2HI(g)  H2(g) + I2(g)达到平衡状态的标志是:① I2的体积分数不再变化;② 生成1 mol H2同时消耗1 mol I2;③ 容器内压强不再变化;④ 生成2 mol HI同时消耗1 mol H2;⑤ 气体的密度不再变化;⑥ 混合气体的平均式量不再变化()
H2(g) + I2(g)达到平衡状态的标志是:① I2的体积分数不再变化;② 生成1 mol H2同时消耗1 mol I2;③ 容器内压强不再变化;④ 生成2 mol HI同时消耗1 mol H2;⑤ 气体的密度不再变化;⑥ 混合气体的平均式量不再变化()
| A.①②③④⑤⑥ | B.①②③⑤⑥ | C.①②⑤⑥ | D.①② |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y核外电子数的一半,Y与M可形成化合物 。下列说法正确的是( )
。下列说法正确的是( )
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
C.YX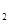 、M 、M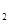 Y都是含有极性键的分子 Y都是含有极性键的分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
下列说法正确的是()
| A.化学反应既遵守“质量守恒”定律,也遵守“能量守恒”定律 |
| B.HF、HCl、HBr、HI的的稳定性依次增强 |
| C.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| D.两种粒子,如果核外电子排布相同,则它们互为同位素 |